Введение
В 1989 г. Irwin Rozenberg для описания потери массы скелетной мускулатуры с возрастом предложил использовать термин «саркопения» (греческий термин sarx – тело, плоть и penia – снижение). В 1998 г. Richard Baumgartner описал саркопению как синдром, ассоциированный с повышенным риском падений и физической слабостью [1].
Саркопения – синдром, который характеризуется прогрессивным и генерализированным снижением скелетной мышечной массы, ее силы и риском развития таких осложнений, как нарушение подвижности, снижение качества жизни и смерти (European Working Group on Sarcopenia in Older People, EWGSOP, 2018) [2].
Для постановки диагноза «саркопения» необходимо определение не только скелетной мышечной массы, но и ее силы и функциональных возможностей, так как сила мышечной массы не зависит исключительно от ее массы и взаимосвязь между данными показателями не является линейной.
Диагностические критерии саркопении (EWGSOP, 2018) [2].
1. Снижение мышечной массы.
2. Снижение мышечной силы.
3. Снижение мышечной функции.
Постановка диагноза саркопении основывается на выявлении двух из трех вышеперечисленных критериев. Наличие первого критерия является обязательным.
Стадийность развития саркопении отображает тяжесть состояния. Рабочая группа EWGSOP выделила три стадии развития саркопении:
- I – пресаркопения, характеризуется снижением мышечной массы без снижения ее силы и функции;
- II – саркопения, характеризуется снижением скелетной мышечной массы, ее силы или функции;
- III – тяжелая форма саркопении, характеризуется снижением всех трех параметров (мышечной массы, ее силы и функции) [3].
В основе саркопении лежат обычно несколько патологических процессов: снижение числа мышечных волокон, уменьшение их размера, нарушения иннервации миофибрилл, а также жировая инфильтрация мышц (миостеатоз) [4, 5]. Одной из особенностей ассоциированной со старением саркопении считают относительное несоответствие между мышечной массой и мышечной функцией, что может быть отчасти обусловлено миостеатозом [4, 5]. Жировую инфильтрацию мышц также рассматривают как часть процессов старения, причем не всегда зависящую от наличия системного ожирения. В основе миостеатоза может лежать возрастное сокращение физической активности, а жировая инфильтрация мышц приводит, в свою очередь, к дополнительному ослаблению их сократительной активности, уменьшению мышечной силы и функциональных способностей людей преклонного возраста. В возникновении миостеатоза определенную роль играют также адипокины (главным образом лептин), половые гормоны, глюкокортикостероиды и нарушения метаболизма глюкозы. В ряде исследований показано, что жировая инфильтрация мышц не только приводит к потере мышечной массы и силы, но и способствует возникновению инсулинорезистентности и сахарного диабета 2 типа [4].
Следует отметить, что в последние годы взгляд на функции скелетной мускулатуры существенно изменился. Если прежде основной ее функцией считали механическую, то сейчас установлено, что мышечная ткань также представляет собой своеобразный эндокринный орган и принимает активное участие в регуляции метаболических процессов в других органах и тканях. Была предложена концепция «мышцы – секреторный орган», объясняющая многогранное воздействие мышечной системы синтезом и секрецией различных миокинов [4, 6]. Миокины представляют собой цитокины и иные пептиды, реализующие свои эффекты в других органах и системах и имеющие большое значение для понимания не только процессов саркопении, но и разнообразной другой патологии [4, 6].
В качестве одного из важнейших миокинов в последнее время рассматривают такой классический провоспалительный цитокин, как интерлейкин-6 (IL-6). Примечательно, что физические упражнения способны вызывать десятикратное возрастание концентрации IL-6 в сыворотке крови за счет его синтеза и высвобождения из скелетных мышц [6].
Наряду с этим показано, что IL-6 может увеличивать доступность глюкозы и липидов посредством стимуляции гликогенолиза и липолиза в скелетных мышцах, а также способен вмешиваться в передачу сигналов инсулина [4, 6, 7]. Такой миокин, как IL-15, способен обеспечивать взаимодействие между мышечной и жировой тканью, а IL-8 вовлечен в процессы ангиогенеза [6]. Поскольку синтез миокинов связан с сокращением мышц, то отсутствие физической активности может вызвать дисбаланс миокинов, что, в свою очередь, будет способствовать каскаду развития саркопении, накоплению жировой ткани, стимуляции субклинического воспаления, метаболическим и другим нарушениям [4, 6]. Уменьшение двигательной активности по мере старения человека вполне естественно и может быть обусловлено множеством различных причин, в частности наличием заболеваний, вызывающих болевые синдромы или астению [5].
Для диагностики саркопении целесообразно применять предложенный EWGSOP2 алгоритм F-A-C-S, который означает «Найти (Find) – Оценить (Assess) – Подтвердить (Confirm) – Тяжесть (Severity)» [8].
Для оценки мышечной силы верхней конечности в обычной врачебной практике рекомендуется использовать кистевую динамометрию. Нормальным показателем для женщин считается сила сжатия динамометра >20 кг, для мужчин – >30 кг. Мышечная сила различных групп мышц тела тесно взаимосвязаны друг с другом, поэтому, определив силу кисти ручным динамометром, мы можем анализировать мышечную силу всего тела [9].
Потеря скелетно-мышечной массы может быть диагностирована с помощью биоимпедансного анализа состава тела (англ. bioelectrical impedance analysis, BIA). BIA стал популярным неинвазивным, недорогим и быстрым методом оценки состава тела в различных популяциях, особенно оценки саркопении в гериатрии. Среди показателей, рассчитываемых при помощи биоимпедансометрии, выделяют фазовый угол (англ. phase angle, PhA) как практическую альтернативу использованию мышечной массы для мониторинга физического состояния здоровья и риска неблагоприятных событий [10]. PhA считается чувствительным индикатором здоровья клеток и составляет от 5 до 7 у здоровых взрослых, у женщин он обычно ниже, чем у мужчин. PhA уменьшается с возрастом и положительно коррелирует с мышечной силой [11].
Внутримышечная соединительная ткань играет важную роль в развитии и росте мышечной ткани, а ее количество и распределение сильно различаются между мышцами с различными функциональными свойствами. Однако удивительно, что относительно мало известно о свойствах и адаптации IMCT по сравнению со знаниями о мышечной функции и пластичности [12]. Для описания внеклеточного матрикса (англ. extracellular matrix, ECM) внутри мышцы использовалось несколько различных общих терминов и сокращений. Термин «внутримышечная соединительная ткань» (IMCT) будет использоваться здесь последовательно.
Основными компонентами IMCT являются волокнистый коллаген типов I и III в матрице протеогликанов, при этом неволокнистый тип IV присутствует в базальной мембране мышечных клеток. Также присутствуют небольшие количества волокнистого коллагена типа V и несколько коллагенов, связанных с волокнами. Эндомизий и перимизий имеют различные составы протеогликанов и коллагенов, как подробно описано [13]. Light N. и Champion A.E. подсчитали, что тип III составлял 16% от общего количества (тип I + III) в эпимизии, 28% в перимизии и 62% эндомизия в бычьей грудной мышце. Эти пропорции различаются между IMCT разных мышц [14]. Сравнивая шесть бычьих мышц, Light N. и др. сообщили о содержании типа III в диапазоне 14–30% в эпимизии, 25–43% в перимизии и гораздо меньших колебаниях 53–58% в эндомизии [15].
По мнению авторов, целесообразно предположить, что наличие полиморфизмов генов (rs1800012_COL1A1, rs1800255_COL3A1, rs7787362_ELN, rs1799750_MMP1), ответственных за синтез и распад коллагена I и III типа, эластина, также могут влиять на качество мышечной ткани и вести к риску пресаркопении и ранней саркопении мышц лица и тела.
Важно отметить, что эластин и коллаген, входящие в состав соединительной ткани, также ответственны за каркас легких. Эти белки окружают альвеолы, предотвращают их коллапс при инсуффляции и дефляции во время акта дыхания, а также поддерживают мелкие дыхательные пути. С возрастом и в силу ряда патологий отмечаются значительные структурные изменения соединительной ткани, при этом эластическая тяга легких уменьшается, что препятствует быстрому и полному выходу альвеолярного газа при выдохе, ухудшается бронхиальная проходимость (более выраженное спадение бронхов отмечается на выдохе) [16].
Снижение дыхательной функции начинается примерно с 25 лет: показатель объема форсированного выдоха за 1-ю секунду и форсированной жизненной емкости легких (ФЖЕЛ) снижаются примерно на 30 мл в год у мужчин и на 23 мл в год – у женщин, причем это снижение усиливается в возрасте старше 65 лет [17].
При диагностике респираторной саркопении (РС) рекомендуется определять показатель ФЖЕЛ с помощью спирографии, т.к. по результатам недавно проведенного исследования с участием пожилых людей (n=554) продемонстрировано, что пиковая скорость выдоха (ПСВ) неприемлема в качестве диагностического критерия РС при наличии у пациентов сопутствующих обструктивных нарушений, а на показатель ФЖЕЛ податливость грудной клетки оказывает большее влияние, чем сила дыхательных мышц [18].
Объем форсированного выдоха за первую секунду (ОФВ1) является одним из ключевых показателей спирометрии и отражает количество воздуха, выдыхаемого из легких в первую секунду после максимального вдоха. В контексте респираторной саркопении, снижение ОФВ1 может указывать на нарушение функции легких, связанное с мышечной слабостью, в том числе и дыхательных мышц.
Цель работы: изучить генетическую и фенотипическую предрасположенность к пресаркопении и ранней саркопении у женщин в возрасте 35–55 лет, в т.ч. при признаках недифференцированной дисплазии соединительной ткани, (нДСТ) и оценить возможности комбинированной методики синхронизированного монополярного RF-лифтинга и электрического поля высокого напряжения (HIFES) в качестве профилактики и коррекции возрастных изменений при разных типах старения.
Материалы и методы
Дизайн исследования: Было проведено пилотное одноцентровое проспективное когортное исследование.
Критерии соответствия:
Критерии включения:
- женский пол;
- возраст 18 и более лет;
- индекс массы тела <30 кг/м2;
- с разными типами старения;
- с наличием признаков в нарушении синтеза и распада коллагена.
Критерии невключения:
- наличие в анамнезе гипертрофических или келоидных рубцов;
- наличие признаков активной инфекции, системные заболевания соединительной ткани;
- имплантированное электрическое устройство любого типа;
- беременность, лактация;
- процедуры монополярного RF-лифтинга, микрофокусированного ультразвука, ботулотоксина или лазера в течение предыдущих 6 месяцев, а также лечение с использованием филлеров для лица в течение предыдущих 12 месяцев.
Критерии исключения: осложнения и отказ от продолжения лечения.
Объективные измерения
Биоимпедансный анализ состава тела проводили с помощью аппарата АВС-02 («Медасс», Россия) по стандартной методике, с подсчетом фазового угла. Показатели мышечной силы оценивали методом кистевой динамометрии с помощью механического кистевого динамометра ДК-50 (АО «Нижнетагильский медико-инструментальный завод», Россия) с подсчетом средней силы хвата кисти правой и левой руки.
Спирометрическое исследование для оценки вентиляционной функции легких выполнено при помощи спирометра BTL-08 Spiro Pro (BTL, Великобритания). Исследование проводилось по стандартной методике с оценкой емкостных и скоростных показателей спирометрии [13].
Материалом для молекулярно-генетического исследования служил буккальный эпителий. ПЦР проводили с помощью амплификатора Rotor Gene Q (Qiagen, Германия). Секвенирование по Сэнгеру осуществляли с помощью секвенатора SeqStudio (Thermo Fisher, США).
Также были использованы опросник SARC-F1 [19] и скрининговая анкета по выявлению предрасположенности к недифференцированной дисплазии соединительной ткани (нДСТ) [20].
Метод коррекции и профилактики пресаркопении и ранней саркопении лица был выполнен с помощью аппарата Emface (BTL, Великобритания), в основе которого лежит технология синхронизированного монополярного RF-лифтинга и электрического поля высокого напряжения HIFES.
Оценка улучшения после курса терапии была проведена c помощью опросника FACE-Q [21].
Методы статистического анализа данных
Сбор данных, их последующая коррекция, систематизация исходной информации и визуализация полученных результатов осуществлялись в электронных таблицах Microsoft Office Excel (2016). Статистическая обработка результатов проводилась средствами языка программирования Python (v. 3.12, Python Software Foundation, https://www.python.org).
Количественные показатели оценивались на предмет соответствия нормальному распределению, для этого использовался критерий Шапиро–Уилка. Проверка на нормальность распределения показала, что данные в исследовании не имеют нормального распределения. Поэтому в дальнейшем расчеты производились методами непараметрической статистики.
В случае описания количественных показателей, имеющих распределение, отличное от нормального, в качестве центра распределения была определена медиана, а в качестве показателей вариации – квартили (Me [Q1; Q3]). Для сравнения двух несвязанных выборок использовался U-критерий Манна–Уитни. Для сравнения трех и более несвязанных выборок использовался критерий Краскела–Уоллиса, являющийся непараметрической альтернативой однофакторного дисперсионного анализа.
Результаты качественных признаков выражены в абсолютных числах с указанием долей (%). Сравнение номинальных данных в группах проводилось при помощи критерия χ2 Пирсона. В тех случаях, когда число ожидаемых наблюдений в любой из ячеек четырехпольной таблицы было менее 10, для оценки уровня значимости различий использовался точный критерий Фишера.
Различия считались статистически значимыми при p≤0,05, использовали двусторонний р-уровень значимости.
На первом и последнем сеансе была сделана фотодокументация с фронтальной, левой косой, правой косой, левой боковой и правой боковой проекциями. Перед регистрацией все пациенты были проинформированы о терапевтических преимуществах, рисках и возможных осложнениях. Перед процедурами, связанными с исследованием, пациенты давали свое письменное информированное согласие на лечение и последующую публикацию любых изображений пациентов. Это исследование было проведено в соответствии с Хельсинкской декларацией 1964 г. и последующими поправками.
Результаты исследования
Участники исследования
В пилотном исследовании участвовали 36 женщин в возрасте 37,0 [34,0; 48,0] лет (от 35 до 55 лет), весом 57,5 [52,45; 62,25] кг, ростом 165,0 [162,75; 167,25] см и ИМТ 21,3 [19,69; 23,55].
Основные результаты исследования
Всем пациентам было проведено генетическое тестирование маркеров (rs1800012_COL1A1, rs1800255_COL3A1, rs7787362_ELN, rs1799750_MMP1), ответственных за синтез и распад коллагена и эластина (табл. 1–4, рис. 1–4).


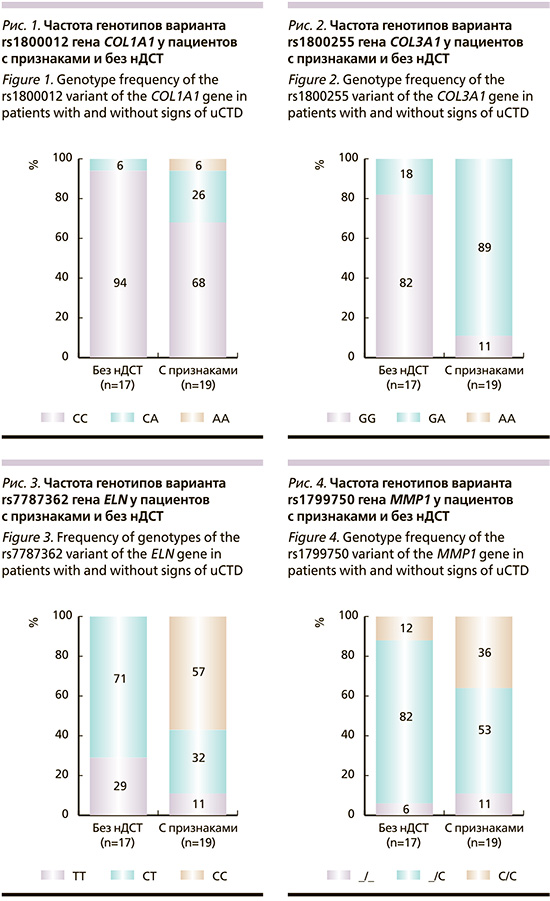
Генетические показатели ассоциированы с результатами анкеты по фенотипическим признакам недифференцированной дисплазии соединительной ткани (НДСТ).
Частота носительства альтернативных аллелей варианта rs1800255 гена ELN частота носительства также была выше при нДСТ – 89% против 71% (p=0,001), при этом генотип CC rs7787362 выявлен у 57% пациентов с нДСТ.
Для варианта rs1800012 гена COL1A1 частота носительства альтернативного аллеля (гетеро- или гомозигота) составила 32% при НДСТ и 6% в контроле (p=0,092).
Анкета по дисплазии показала статистически значимые различия в группах пациентов с признаками нДСТ и без по сумме баллов (15 [15; 15] vs 10 [10; 10], p<0,001) (табл. 5).

Другие параметры антропометрических показателей физического функционирования у пациентов, участвующих в исследовании, представлены в табл. 5.
Также все пациенты были разделены на группы в зависимости от типа старения. Оценка удовлетворенности c помощью опросника FACE-Q (оценка пациентом) после курса процедур Emface представлена в табл. 6 и на рис. 5.

Была проведена оценка удовлетворенности после курса процедур Emface c помощью опросника FACE-Q среди пациентов с признаками нДСТ в зависимости от типа старения. Статистически значимого различия выявлено не было. Однако клинически значимым оказалась удовлетворенность среди пациентов с мышечным типом старения, но мелкоморщинистый и отечно-деформационный типы старения показали более высокие показатели удовлетворенности (табл. 7, рис. 6).

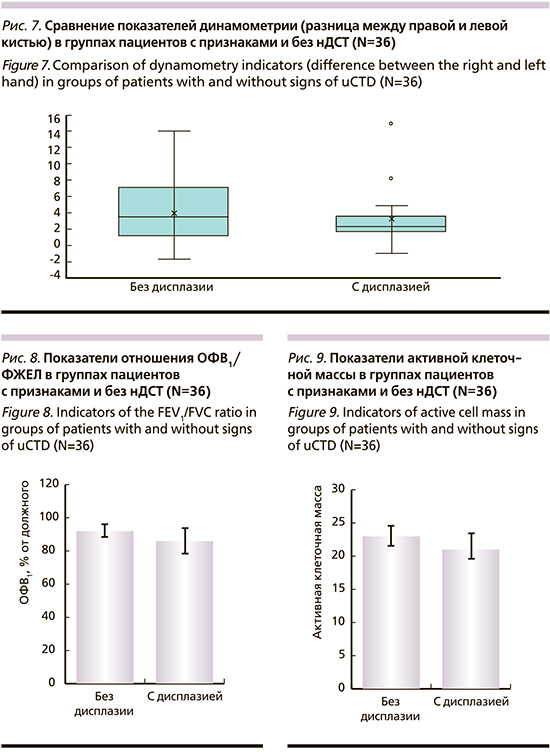
При сравнении показателей динамометрии было выявлено, что в группе пациентов с признаками нДСТ сила сжатия кисти (правой и левой кистью) статически значимо ниже (р=0,001). Разница между правой и левой кистью статически значимо в группах не различаются (рис. 7).
Опросник SARC-F1 показал низкую чувствительность и специфичность в обеих группах, что требует создания скрининговых анкет для выявления факторов риска саркопении и пресаркопении у молодых пациентов.
Спирометрические характеристики показали, что пациенты с признаками нДСТ имеют более низкие показатели, чем группа лиц без нДСТ. Отношение ОФВ1/ФЖЕЛ при сравнении p=0,103, что свидетельствует о наличии тенденции к значимости (рис. 8).
При анализе показателей биоимпедансометрии выявлено, что активная клеточная масса имеет тенденцию к значимости при сравнении групп с признаками и без нДСТ (p=0,073) (рис. 9).
Обсуждение
Монополярные RF-технологии генерируют объемное тепло посредством высокочастотного электрического тока. Объемное нагревание захватывает глубокую дерму, жир, фиброзные перегородки и фасции [10], что приводит к лифтингу тканей до 4–6 месяцев [11].
В свою очередь HIFES генерирует сильные электрические поля, которые воздействуют на подлежащие нейроны и мышечную ткань. Эти электрические поля деполяризуют мембрану мотонейронов, иннервирующих мышцу. При активации мотонейронов сигнал передается в нервно-мышечное соединение, где нейрон соединяется с мышцей. Этот сигнал заставляет мышцу непроизвольно сокращаться, минуя контроль мозга. Высокоинтенсивная стимуляция лица предотвращает расслабление мимических мышц между импульсами, вызывая непрерывные сокращения [22].
HIFES индуцирует электрические поля для избирательного сокращения мышц леваторов, поскольку тонус мышц лица имеет решающее значение для обеспечения поддержки окружающих мягких тканей. Повторное применение HIFES инициирует синтез мышечного белка и может вызвать уплотнение мышечной ткани, что особенно важно у пациентов с нДСТ. Напротив, изменения, вызванные монополярным RF нагревом, затрагивают структуру дермы и подкожную архитектуру. Как было обнаружено в предыдущих исследованиях, в частности, неоколлегенез и неоэластогенез происходят через несколько недель после терапии, что регистрируется как общее улучшение внешнего вида кожи и ее свойств [23].
Технология Emface использует синхронизированный RF-лифтинг и HIFES одновременно для воздействия на все слои лица: кожу, фасции, соединительнотканный каркас и лицевые мышцы для достижения эстетического ремоделирования всего лица. Воздействие на все эти слои неинвазивным способом приводит к улучшению текстуры кожи, уменьшению морщин и общему эффекту лифтинга, заметному в верхней и средней трети.
Интересно, что все пациенты с признаками нДСТ в нашем исследовании испытали улучшение после курса из 6 процедур, что может объясняться более медленным нарастающим эффектом и фактором снижения синтеза коллагена и эластина, снижением мышечного потенциала тканей, но ярким результатом, в отличие от пациентов без признаков нДСТ. Требуются дальнейшие исследования для разработки скрининговых методов по выявлению рисков пресаркопении и саркопении у пациентов косметологического профиля.
Выводы: В результате исследования удалось выявить диагностические критерии риска развития пресаркопении и саркопении у пациентов с нДСТ. Обнаруженные ассоциации между признаками и диагностическими возможностями оценки риска пресаркопении и саркопении (биоимпедансометрия, динамометрия, спирометрия и скрининговая анкета по выявлению предрасположенности к недифференцированной дисплазии соединительной ткани (нДСТ) подчеркивают целесообразность применения индивидуализированного подхода, включающего молекулярно-генетическую диагностику. Комбинированная методика синхронизированного монополярного RF-лифтинга и электрического поля высокого напряжения (HIFES) потенциально применима в составе профилактических программ, однако для подтверждения ее вклада в профилактику развития саркопении требуются контролируемые исследования с длительным периодом наблюдения.
Клинический случай 1
Анамнез: Пациентка Я., ИМТ – 19,1, обратилась с жалобами на птоз нижней трети лица, потерю четкости овала, а также углубление носогубных складок. Из анамнеза известно, что пациентка в течение 2 лет носила ортодонтическую брекет-систему (со слов пациентки – коррекция прогнатии, процесс лечения завершен), однако пациентка ощущает психологический дискомфорт за счет внешних изменений эстетики лица. При осмотре – отсутствие четкого овала, гипертонус жевательной мышцы слева.
Пациент ведет активный образ жизни, имеет адекватные физические нагрузки. Анамнез не отягощен, хронических заболеваний нет.
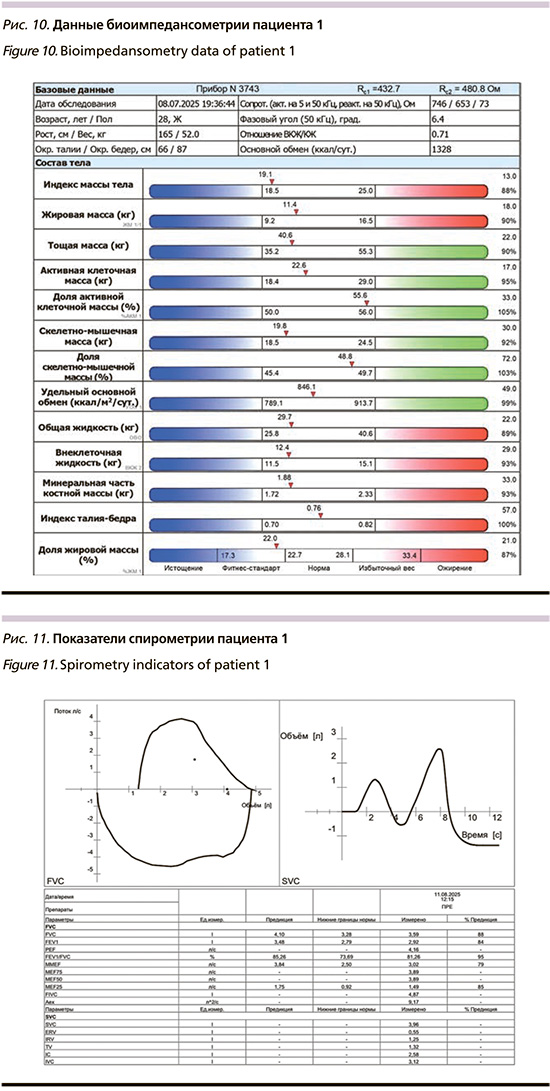
Данные биоипедансометрии представлены на рис. 10, характеризуются нормальной массой тела, сохраненными жировым и мышечно-белковым компонентами, нормальной гидратацией, адекватным уровнем минерального компонента костной массы и физиологическим фазовым углом.
Показатели динамометрии составили: для правой кисти 28,5 кг и для левой кисти 23,4 кг.
В совокупности с результатами динамометрии данные биоипедансометрии указывают на отсутствие признаков пресаркопении и нутритивного дефицита за счет физической активности и сбалансированного потребления белка, несмотря на генетическую предрасположенность.
Показатели спирометрии представлены на рис. 11.
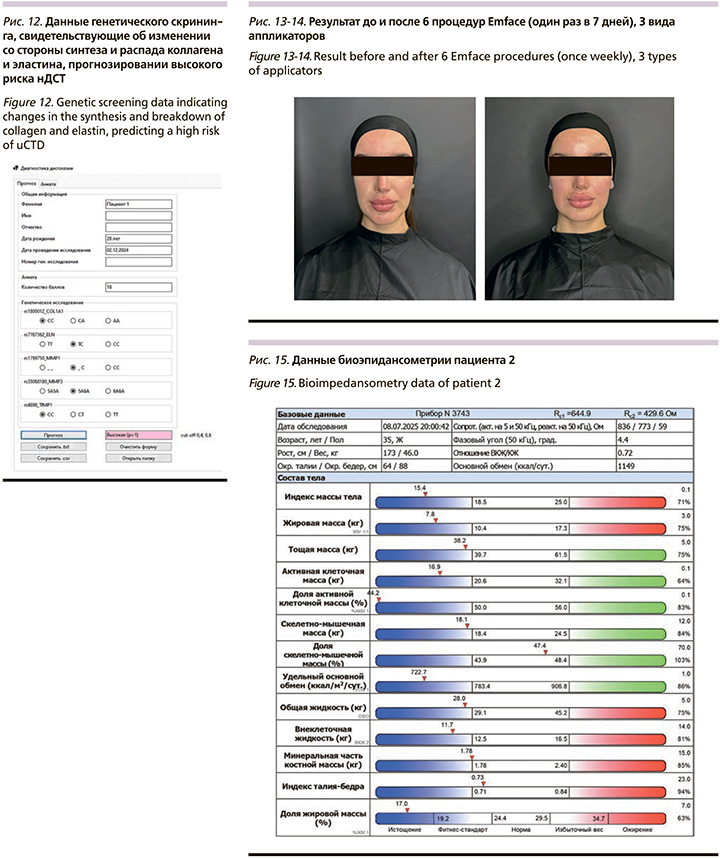
Анализ генетического тестирования и анкетирования (сумма баллов 18) выявил предрасположенность к признакам нДСТ (рис. 12). При скрининге была использована программа для ЭВМ для прогнозирования вероятности выявления нДСТ [24].
Диагноз: М35.8 недифференцированная дисплазия соединительной ткани.
L90.8 Другие атрофические изменения кожи.
Протокол: 6 процедур Emface (один раз в 7 дней), 3 вида аппликаторов
Результат: Учитывая фенотипические и генетические признаки нДСТ (недифференцированная дисплазия соединительной ткани), являлось обоснованным назначение технологии Emface с целью улучшения мышечной ткани, трофики тканей и стимуляции синтеза коллагена и эластина. В результате курса процедур был достигнут положительный эффект, устранение ассиметрии, лифтинг тканей и восполнение утраченного объема в средней трети лица (рис. 13-14).
Клинический случай 2
Анамнез: Пациентка А., астенического телосложения, ИМТ – 15,4 кг/м², обратилась с жалобами на наличие губоподбородочных морщин и снижение тонуса кожи. Физические нагрузки отрицает. Анамнез без особенностей, хронических заболеваний нет. Пациентка неоднократно обращалась за косметологической помощью, отмечает отсутствие длительного эффекта после лифтинговых процедур.
Данные биоимпедансометрии представлены на рис. 15.
Индекс массы тела (ИМТ) составил 15,4 кг/м², что существенно ниже нижней границы нормы (18,5 кг/м²) и соответствует критериям выраженного дефицита массы тела.
Жировая масса составила 7,8 кг (16,9% массы тела, при норме 20–30%), данный показатель указывает на значительное снижение жирового депо.
Показатели тощей массы тела и активной клеточной массы (АКМ) составили 38,2 кг и 16,9 кг соответственно, что соответствует 75% и 64% от нормативных значений. Фазовый угол составил 4,4°, что ниже среднестатистических значений для здоровых женщин.
Анализ полученных данных выявил сочетание выраженного дефицита массы тела, снижения жировой и мышечной массы, умеренной пресаркопении и низкой активной клеточной массы. Подобный фенотип биоимпедансометрии характерен для хронического нутритивного дефицита, наблюдающегося при недостаточном поступлении белка и энергии.
Снижение фазового угла и АКМ коррелирует с ухудшением прогноза и риском развития пресаркопении.
Показатели динамометрии составили: для правой кисти 22,5 кг и левой кисти 20,2 кг.
Показатели спирометрии представлены на рис. 16.

Анализ генетического тестирования и анкетирования (сумма баллов 10) выявил низкий риск предрасположенности к нДСТ (рис. 17). При скрининге была использована программа для ЭВМ для прогнозирования вероятности выявления нДСТ [24]. Несмотря на низкую вероятность нДСТ, но с учетом анамнеза (гиподинамия, несблансированное питание), пациент может быть отнесен в группу риска по развитию пресаркопении и ранней саркопении, при отсутствии своевременной коррекции образа жизни.
L90.8 Другие атрофический изменения кожи.
Протокол: 4 процедуры Emface (один раз в 7 дней) 3 вида аппликаторов.
Результат: Учитывая фенотипические и генетические признаки по несостоятельности синтеза коллагена и эластина, но при отсутствии риска нДСТ, являлось обоснованным назначение технологии Emface с целью улучшения мышечной ткани, трофики тканей и стимуляции коллагена и эластина. В результате курса процедур был достигнут положительный эффект и лифтинг тканей (рис. 18-19). Также были даны рекомендации по коррекции образа жизни, физическим нагрузкам и питанию.



