Краеугольным камнем, определяющим эффективность программ экстракорпорального оплодотворения (ЭКО), является качество и количество получаемых ооцитов. При этом главным ограничительным механизмом является невозможность с существующих ныне позиций клинически значительно повлиять на количество и компетентность получаемых ооцит-кумулюсных комплексов. Ведь в процессе овариальной стимуляции, когда введение препаратов начинается лишь со 2-го дня менструального цикла, когда фолликулы вышли в гонадотропин-зависимую фазу роста, мы имеем дело уже с предварительного запрограммированным и заложенным фолликулярным пулом, судьба которого предрешена за 90–120 дней до начала протокола ЭКО. О предопределяющей роли гонадотропин-независимого этапа созревания фолликулов на судьбу будущего ооцита и эмбриона говорит также высокая степень межцикловой вариабельности в программах ЭКО [1].
Яичник млекопитающих содержит фолликулы на различных стадиях развития, постоянно претерпевающие процессы циклического рекрутинга, развития и регрессии. Пул примордиальных фолликулов поддерживается в состоянии покоя и служит резервом для циклического рекрутирования фолликулов. Рекрутирование примордиальных фолликулов в основном контролируется паракринной взаимосвязью между ооцитом, гранулезными клетками, соседними текальными и интерстициальными клетками. Пул покоящихся фолликулов находится под строгим контролем ингибирующих факторов; активация происходит при увеличении стимулирующего влияния ключевых сигнальных путей. Последовательность действий во многом опосредована секретируемыми ростовыми факторами [2, 3].
Так, например, показано, что делеция негативного регуляторного белка Pten или потеря экспрессии ингибирующего фактора транскрипции Fox03a приводит к чрезмерной активации PI3K-сигнального пути и преждевременной потере овариального резерва [2, 3]. Процесс выхода примордиальных фолликулов из спящего состояния начинается с 20-й недели внутриутробного развития и продолжается вплоть до менопаузы. Согласно математической модели оценки овариального резерва, у женщин со своевременным наступлением менопаузы (49,6 года) из спящего состояния ежедневно выходит в среднем 29–30 фолликулов; при преждевременном старении яичников этот показатель не превышает трех фолликулов. С возрастом число рекрутируемых примордиальных фолликулов при своевременном выключении функции яичников снижается и к 35 годам достигает 17 фолликулов в сутки. К 44–45 годам эта величина достигает трех фолликулов [4, 5].
В ряде исследований, обнаруживших овариальные стволовые клетки в кортексе яичников, была опровергнута догма о конечном числе ооцитов у самок млекопитающих. Далее данные были подтверждены в исследованиях, проведенных как на ткани яичников мышей, так и других млекопитающих, а также людей [5–7]. Результаты, полученные в этих исследованиях, до сих пор подвергаются сомнению [8].
На данный момент описаны 2 типа стволовых клеток в яичнике: плюрипотентные клетки диаметром 2–4 мкм (very small embryonic-like stem cells, VSEL) и собственно овариальные стволовые клетки, достигающие диаметра 5–8 мкм, экспрессирующие цитоплазматическую изоформу транскрипционного фактора OCT-4В. Среди обнаруженных маркеров описаны SSEA-4, FRAGILIS, DPPA3GAPHD, OCT 4, SOX-2, NANOG, LIN28, STELLADDX4/VASA, MCAM/CD146, Thy-1/CD90, STRO-1, DDX4, DAZL, STRA8, DMC1, PRDM1, SCP3, NANOG, SSEM1 [9–12].
Ряд авторов опровергают наличие стволовых клеток в яичниках млекопитающих на основании исследований, в которых не обнаружена экспрессия маркеров плюрипотентности GDF9, DDX4, ZP3, SYCP3, GFP, SOX2, OCT4, STELLA, SCP3, PRDM9, SCP1, SPO11, C-KIT, TERT, NOBOX, KI-67, PCNA [13–15].
Таким образом, многолетние дискуссии о возможности пополнения овариального пула примордиальных фолликулов за счет плюрипотентных стволовых клеток не завершены.
Большой проблемой, лимитирующей эффективность программ вспомогательных репродуктивных технологий, является распространение в популяции бесплодных пациенток с преждевременной недостаточностью яичников (ПНЯ), а также возраст-ассоциированное снижение количества и качества фолликулов и, как следствие, снижение количества получаемых в программах ЭКО ооцитов и эмбрионов. Проблема ПНЯ является комплексной и ассоциирована с двумя состояниями: сниженным овариальным резервом и истинной ПНЯ. Этиология скорой утраты овариального резерва, как известно, связана с хромосомными Х-ассоциированными аномалиями, а также с точечными мутациями генов, аутоиммунными и ятрогенными факторами [7]. Последние являются наиболее часто встречающимися в клинической практике ситуациями: оперативные вмешательства по поводу доброкачественных и злокачественных опухолей яичников и химио-, лучевая терапия по поводу онкологического заболевания [16].
Генетические факторы являются основными детерминантами менопаузального возраста в общей популяции и связаны примерно с 7% случаев ПНЯ [17–19]. Исследования показали, что у 1 из 1000 женщин в возрасте от 15 до 29 лет и у 1 из 100 женщин в возрасте от 30 до 39 лет возникает ПНЯ [20].
Среди хромосомных аномалий, ассоциированных с ПНЯ, следует отметить синдром хрупкой Х-хромосомы [21], а также анеуплоидии по половым хромосомам, наиболее частой из которых является синдром Шерешевского–Тернера [22]. Также известен ряд Х-сцепленных генетических мутаций, ассоциированных с ПНЯ, затрагивающих гены, кодирующие фактор дифференциации роста-9 (GDF-9) и костный морфогенетический белок-15 (BMP-15) [23]; в то время как аутосомные аномалии были обнаружены в гене FOXL2 [24], а также генах рецептора ФСГ (FSHR) [25], стромального антигена 3 (STAG3) [26], перекрестного комплемента рентгеновской репарации 2 (XRCC2) [27] и MCM8 [28]. Также описаны мутации в генах SMC1B и REC8 [29]. Полное экзомное секвенирование, проведенное Jaillard S. et al., также позволило определить новые гены-кандидаты, этиологически связанные с развитием ПНЯ; к ним относятся NRIP1, XPO1 и MACF1 [30].
В исследовании Heddar А. et al. описали генетический ландшафт, характерный для ПНЯ, на группе из 375 пациенток [31]. Обнаружены убедительные доказательства патогенности 9 генов – ELAVL2, NLRP11, CENPE, SPATA33, CCDC150, CCDC185, включая гены репарации ДНК: C17orf53 (HROB), HELQ, SWI5, определяющие высокую хромосомную хрупкость. В работе подтверждена этиологическая роль генов BRCA2, FANCM, BNC1, ERCC6, MSH4, BMPR1A, BMPR1B, BMPR2, ESR2, CAV1, SPIDR, RCBTB1 и ATG7, о которой ранее сообщалось в ряде исследований. В 8,5% случаев ПНЯ является единственным симптомом мультиорганного генетического заболевания. Были выявлены новые пути, вовлеченные в формирования данного нарушения.
Так, семейство белков NLRP регулирует иммунный ответ на инфекцию через сигнальные пути NF-kB и интерферон I типа [32]. HROB (C17orf53) кодирует недавно идентифицированный белок, участвующий в гомологичной рекомбинации (HR) [33]. Недавние исследования in vitro показали, что белок, кодируемый геном SPATA33, экспрессируется в митохондриях и является медиатором митохондриальной аутофагии [34]. ELAVL2 кодирует РНК-связывающий белок, экспрессирующийся в основном в яичниках, семенниках и нейронах. Он участвует в посттранскрипционной и посттрансляционной регуляции [35].
В литературе также описаны эпигенетические причины ускоренной потери овариального резерва у пациенток репродуктивного возраста [36]. Примерно у 20% женщин с ПНЯ ранее было диагностировано аутоиммунное заболевание, поражающее множество различных органов, включая сердце, почки, щитовидную железу, поджелудочную железу и желудочно-кишечный тракт. Аутоиммунные этиологии ПНЯ делятся на две группы: эндокринные и не эндокринные заболевания [37, 38]. Эндокринные заболевания включают болезнь Аддисона, тиреоидит Хашимото, гипофизит и сахарный диабет 1 типа, а неэндокринные – хронический кандидоз, ревматоидный артрит, идиопатическую тромбоцитопеническую пурпуру, аутоиммунную гемолитическую анемию, пернициозную анемию, целиакию, алопецию витилиго, системную красную волчанку, синдром Шегрена, хронический активный гепатит, первичный билиарный цирроз и аутоиммунные полиэндокринные синдромы I и II.
Основным механизмом формирования быстрой потери резерва ранее считали ускоренной апоптоз фолликулов в процессе созревания фолликулов от примордиальных до антральных. В дополнение к апоптозу было показано, что ингибирование аутофагии вовлечено в потерю фолликулов. Специфический для половых клеток нокаут гена, индуцирующего аутофагию (Atg7), приводит к снижению фертильности из-за значительного снижения овариального резерва.
В случае отсутствия явной ятрогенной причины в анамнезе основа этиологии преждевременной потери овариального резерва – нарушенная активация примордиальных фолликулов, один из ключевых биологических механизмов, лежащих в основе этого явления [1, 39].
На данный момент мы имеем достаточное количество подтвержденных экспериментально данных, для того, чтобы предположить, что наиболее частые структурные и функциональные аномалии яичников, такие как синдром поликистозных яичников, а также ПНЯ, являются крайними проявлениями патологии активности ключевых сигнальных путей.
Неудивительно, что терапия на основе стволовых клеток показала возможный огромный потенциал для лечения ПНЯ как в доклинических, так и в клинических исследованиях и испытаниях [40, 41]. Основными типами стволовых клеток, использование которых описано для лечения ПНЯ, являются: мезенхимальные стромальные клетки (МСК), индуцированные плюрипотентные стволовые клетки, оогониальные или сперматогониальные стволовые клетки и эмбриональные. Последние исследования показывают, что стволовые клетки могут оказывать терапевтическое воздействие паракринным путем [42].
Сведения об имеющихся клинических исследованиях представлены в таблице 1.
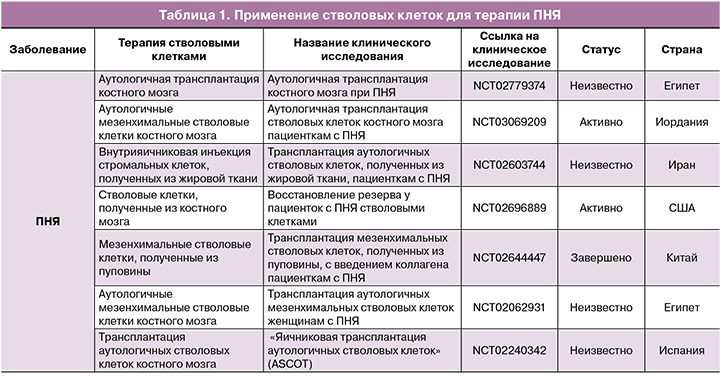
Мезенхимальные стромальные клетки
В литературе были обнаружены многочисленные исследования, в которых МСК из различных источников использовались для преодоления ПНЯ на животных моделях. Во всех этих исследованиях ПНЯ было смоделировано различными способами, в первую очередь, путем использования комбинации химиотерапии циклофосфамидом и бусульфаном [8, 43–45], CDDP [8, 43–49], только циклофосфамидом [38, 50, 51], паклитакселом или бусульфаном [52]. В редких случаях недостаточность яичников была смоделирована естественным старением яичников [53]; иммунизацией пептидами овариального антигена – пеллюцидного гликопротеина 3 (ZP3) [37, 42]; удалением яичников (овариэктомия) [16]; перекисью водорода [54]; FSHR (-/-) мышиная модель (FORK) с нокаутом рецептора ФСГ [55].
МСК из различных источников, таких как эмбриональные стволовые клетки человека [8, 46], клетки яичников [50], пуповины [37, 38, 43, 47, 48, 51], плаценты [16,42], печени плода, амниона [44, 53, 55], хорионической пластинки, менструальной крови (эндометрий) [52] и костного мозга [45, 49, 55], используются для исследований на животных моделях, имитирующих ПНЯ. В подобных исследованиях чаще всего используются стволовые клетки из пуповинной крови человека. В животных моделях МСК чаще всего вводили инъекцией в хвостовую вену [8, 16, 37,3 8, 42, 43–53], реже – внутрибрюшинно [50, 54] или в яичники [44].
Почти все исследования на животных моделях показали положительное влияние трансплантации стволовых клеток на функциональную активность яичников. Среди наиболее частых положительных эффектов после трансплантации МСК по сравнению с контрольной группой – увеличение концентрации половых стероидов в крови, а также повышение уровня антимюллерова гормона (АМГ) и снижение уровня фолликулостимулирующего гормона (ФСГ) [8, 38, 49, 51]; увеличение количества антральных фолликулов [49], снижение активности апоптоза (усиление экспрессии гена Bcl-2 и подавление экспрессии генов Baх и каспазы-3, увеличение соотношения Bcl-2/Bax) и усиление пролиферации (повышение экспрессии Ki67) клеток гранулезы [8, 38, 42, 44, 45, 52, 53], снижение концентрации провоспалительных цитокинов (интерферон (IFN)-γ и интерлейкин-2) [37], увеличение массы и объема яичников [51], стимуляция ангиогенеза (повышенная экспрессия CD31) [44] и подавление оксидативного стресса [16].
Общепринятый консенсус говорит о том, что МСК дифференцируются в гранулезные клетки и таким образом оказывают влияние на созревание ооцитов.
Описанные молекулярные механизмы влияния клеточной терапии на фолликулярный пул включают ингибирование аутофагии через сигнальный путь AMPK/mTOR [47]; активацию пути PI3K [48] и ECM-зависимых сигнальных путей FAK/AKT; паракринную активность за счет высвобождения различных факторов роста, таких, как фактор роста нервов (NGF), рецептор фактора роста нервов (TrkA), эпидермальный фактор роста (EGF), фактор роста гепатоцитов (HGF), фактор роста фибробластов 2 (FGF2), инсулиноподобный фактор роста (IGF-1) и фактор роста эндотелия сосудов (VEGF), секретируемые МСК [38, 53]; регуляцию Treg-клеток и продукция цитокинов [56]; восстановление уровней трансформирующего фактора роста (TGF)-β и IFN-γ в сыворотке и активность теломеразы.
Количество клинических исследований крайне ограничено.
Однако лечение стволовыми клетками сопряжено с повышенным риском развития ряда грозных осложнений; описаны случаи полиорганной недостаточности и нейродегенеративные заболевания [57]. Еще одним потенциальным риском является повышенная иммуногенность. Наибольшую озабоченность вызывает онкогенность стволовых клеток в результате их длительного культивирования, что может привести к накоплению кариотипических аномалий, изменению числа копий и потере гетерозиготности.
Поэтому все больший интерес проявляется к внеклеточным везикулам (ВВ), полученным из стволовых клеток. Исследования показали, что ВВ реализуют свои эффекты через паракринный механизм регуляции, способствуя регенерации. ВВ содержат нуклеиновые кислоты, включая ДНК, мРНК, некодирующие РНК, липиды и различные белки [58]. По сравнению со стволовыми клетками ВВ, полученные из стволовых клеток, обладают множеством преимуществ, включая низкую иммуногенность [59, 60]. Таким образом, полученные из стволовых клеток ВВ считаются более безопасным методом регенеративной медицины для лечения многих, не поддающихся лечению заболеваний, таких как ПНЯ [61].
Терапия с использованием внеклеточных везикул, полученных из мезенхимальных стромальных клеток
Наиболее частым клеточным источником для получения ВВ являются МСК костного мозга, пуповины и жировой ткани. Необходимо отметить, что все исследовательские работы касательно оценки эффективности применения ВВ, опубликованные на данный момент, проводились на лабораторных животных.
ВВ, выделенные из МСК, представляют собой круглые или овальные мембранные везикулы, которые могут агрегировать и распределяться, а их мембранная структура четко определена. Они экспрессируют специфические для ВВ четыре трансмембранных белка-маркера – CD9, CD63, CD81 и белок гена восприимчивости опухоли 101 (TSG101), белок теплового шока 70 (HSP70) и связанный с мультивезикулярным биосинтезом белок ALIX [62–68].
В работе Sun et al. (2017) впервые было описано применение ВВ для лечения ПНЯ [62]. Исследования показали, что ВВ подавляют апоптоз гранулезных клеток in vitro, а лежащий в основе механизм может быть связан с повышением уровня BCL2 и снижением уровня Bax, расщепленной каспазы-3 и PARP [62, 65]. Кроме того, Sun et al. (2017) предполагают, что микроРНК-24, микроРНК-106a, микроРНК-19b и микроРНК-25, содержащиеся во ВВ, также оказывают ингибирующее влияние на активность проапоптических факторов [62]. Механизм положительного эффекта ВВ включает влияние на сигнальный путь Hippo и путь PI3K/AKT [63, 69]. Согласно данным Yang Z. et al. (2019), ВВ также потенцируют усиление ангиогенеза [63]. Некоторые микроРНК, включая miR-126-3p, miR-21, miR-29a и miR-17-5P, могут играть роль на посттранскрипционном уровне [61, 66–68]. Связываясь с 3′UTR генов-мишеней, эти микроРНК подавляют экспрессию определенных молекул, подавляя продукцию реактивных форм кислорода и апоптоз, а также способствуя выживанию, пролиферации и ангиогенезу клеток (табл. 2).
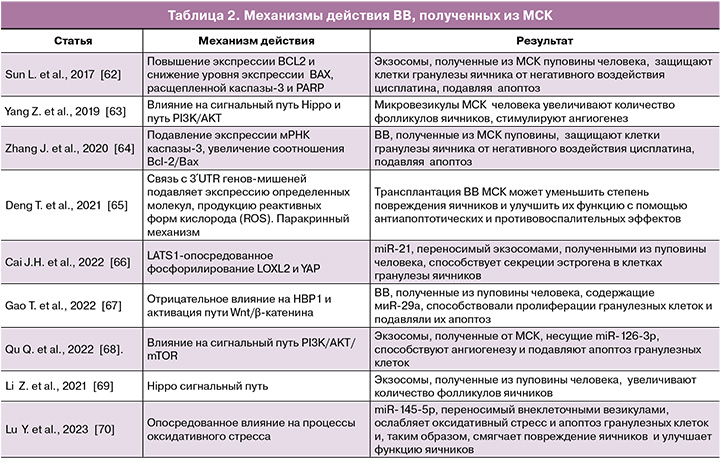
Работа Li Z. et al. продемонстрировала лечебное воздействие ВВ, полученных из МСК пуповины человека [69]. ВВ, полученные из МСК, могут превращаться в поврежденные цисплатином гранулезные клетки, таким образом, играя важную роль в устойчивости к апоптозу, индуцированному цисплатином, и восстанавливая синтез и секрецию стероидных гормонов в гранулезных клетках. Это может обеспечить теоретическую и экспериментальную основу для использования ВВ, полученных из МСК, вместо МСК в качестве более безопасной и бесклеточной терапевтической стратегии для пациентов с ПНЯ, индуцированной химиотерапевтическими агентами.
Точно так же было доказано, что уровни экспрессии общего AKT, p-AKT и ангиогенных цитокинов (включая VEGF, IGF и ангиогенин) в яичниках мышей с ПНЯ заметно повышались после введения микровезикул, полученных из МСК, что позволяет предположить, что трансплантированные микровезикулы могут восстанавливать функцию яичников, индуцируя ангиогенез через сигнальный путь PI3K/AKT [63].
Заключение
Представленная информация о путях воздействия ВВ раскрывает перспективы лечения бесплодия у сложной категории пациенток. Дальнейшие исследования механизмов функционирования, точек приложения ВВ необходимы для расширения терапевтических возможностей.



