Роль Clostridium difficile в качестве этиологического фактора диареи была впервые показана в 1978 г., однако в настоящее время масштабы инфекции, вызываемой данным возбудителем, достигли эпидемического уровня, а частота и тяжесть заболевания продолжают увеличиваться не только во внутрибольничных, но и во внебольничных условиях [1]. Несмотря на успехи, достигнутые в диагностике и терапии Clostridium difficile-ассоциированных инфекций (CDI), продолжает расти частота их неблагоприятных исходов, включая летальные. Это обусловливает необходимость поиска новых лекарственных средств (ЛС) для ее лечения.
Эпидемиология и факторы риска развития инфекции, вызванной Clostridium difficile
Заболеваемость CDI начала существенно расти с конца 1990-х гг. [2]. За последнее десятилетие частота CDI в экономически развитых странах выросла на 200–400 % [3]. Только в США ежегодно регистрируется примерно 700 тыс. новых случаев CDI, которая вышла в стране на первое место среди всех инфекций, ассоциированных с оказанием медицинской помощи (healthcare-associated infections), оттеснив на второе место инфекцию, вызываемую метициллинорезистентным Staphylococcus aureus (MRSA) [4]. При этом во всем мире увеличивается частота и тяжесть внебольничных случаев CDI, которые занимают в структуре заболеваемости от 20 до 41 % и встречаются с частотой 20–30 случаев на 100 тыс. населения [5–7]. Частота CDI среди детей за последние 20 лет увеличилась в 12,5 раз [8, 9]. Одновременно повысилась тяжесть инфекции, а связанная с ней смертность увеличилась с 1999 по 2011 г. в 4 раза [10, 11]. По данным исследования, проведенного в медицинских учреждениях 14 стран Европы, тридцатидневная смертность при CID колеблется в пределах от 2,8 до 29,8 % [12], летальность во время вспышки CDI в канадской провинции Квебек в начале ХХI в. составила 6,9 % [13]. Неблагоприятные исходы наблюдаются у 40 % пациентов с внебольничной CDI, требующих госпитализации [14]. Возможно, это связано с появлением новых факторов риска развития CDI, а также распространенностью во всех регионах мира нового гипервирулентного штамма C. difficile BI/NAP1/027, характеризующегося резистентностью к фторхинолонам и гиперпродукцией токсина [15].
Традиционными факторами риска развития CDI считаются пожилой (> 65 лет) возраст, недавняя госпитализация, пребывание в стационаре или другом учреждении длительного оказания помощи, антибиотикотерапия и коморбидность (злокачественные новообразования, хроническое заболевание почек, воспалительное заболевание кишечника и иммуносупрессия) [2]. Повышение заболеваемости связывают в т.ч. с внедрением в медицинскую практику новых препаратов группы фторхинолонов [2], однако результаты недавно проведенного мета-анализа свидетельствуют, что роль фторхинолонов не следует переоценивать, т.к. CDI наиболее часто развивается при лечении цефалоспоринами и клиндамицином [16].
Дополнительные факторы риска включают контакты с активными носителями, потребление контаминированных продуктов питания, гипоальбуминемию, применение ингибиторов протонной помпы и, возможно, других кислотоснижающих ЛС, желудочно-кишечные эндоскопические процедуры и энтеральное питание через зонд [1, 3].
Отсутствие традиционных факторов риска для пациентов с внебольничной CDI и ее распространенность в группах населения, которые ранее рассматривались как имеющие низкий риск развития инфекции, например для детей и женщин в послеродовом периоде, позволяют предположить, что существуют и другие факторы риска [17, 18]. В ряде исследований показано, что в недавнем анамнезе подавляющего большинства пациентов с внебольничной CDI (до 94 %) выявляется амбулаторное посещение медицинского учреждения, что позволяет предположить, что даже кратковременный контакт с учреждениями здравоохранения служит фактором риска развития CDI [8, 19, 20]. К потенциальным факторам риска, с которыми может быть связано повышение частоты внебольничной CDI, относятся потребление контаминированной пищи и передача инфекции от человека к человеку, из окружающей среды к человеку и, возможно, от животного к человеку [1]. Резервуаром C. difficile служат бессимптомные колонизированные лица [21]. У домашних животных и скота C. difficile определяется в качестве как комменсала, так и патогена, а ее споры могут присутствовать в пище, в т.ч. в мясе, птице, морепродуктах и свежих овощах [22–26].
Предполагают, что передача инфекции от человека к человеку является важным путем распространения инфекции как в больничных, так и во внебольничных условиях. Значительную роль в трансмиссии C. difficile при несоблюдении гигиенических мер профилактики могут сыграть колонизированные медицинские работники и посетители больниц [27], а в качестве фактора риска развития рецидивов CDI у женщин в послеродовом периоде рассматривается бессимптомная колонизация детей [28]. Повторные эпизоды инфекции развиваются у 13–50 % пациентов [29], в 50–90 % случаев они являются истинным рецидивом, т.е. вызваны тем же штаммом C. difficile, что и первичный случай [30]. Также возможно реинфицирование другими штаммами микроорганизма. Частота рецидивов в рандомизированных контролируемых исследованиях составила 25 % [31, 32].
Факторы риска развития рецидива CDI включают нарушения иммунитета, исходное плохое состояние здоровья (хроническая почечная недостаточность, химиотерапия, сопутствующая бактериальная инфекция, срочная госпитализация/пребывание в палате интенсивной терапии/длительная госпитализация), нарушение кишечной микрофлоры, тяжесть первичной CDI и применение кислотоснижающих ЛС [3]. В систематическом обзоре 68 исследований наиболее значимым фактором риска оказались пожилой возраст, использование сопутствующих антибиотиков после установления диагноза CDI, применение ингибиторов протонной помпы и тип штамма возбудителя [33]. Смертность ассоциировалась с пожилым возрастом, коморбидностью, гипоальбуминемией, лейкоцитозом, острой почечной недостаточностью и инфекцией, вызванной штаммом BI/NAP1/027.
Фармакотерапия
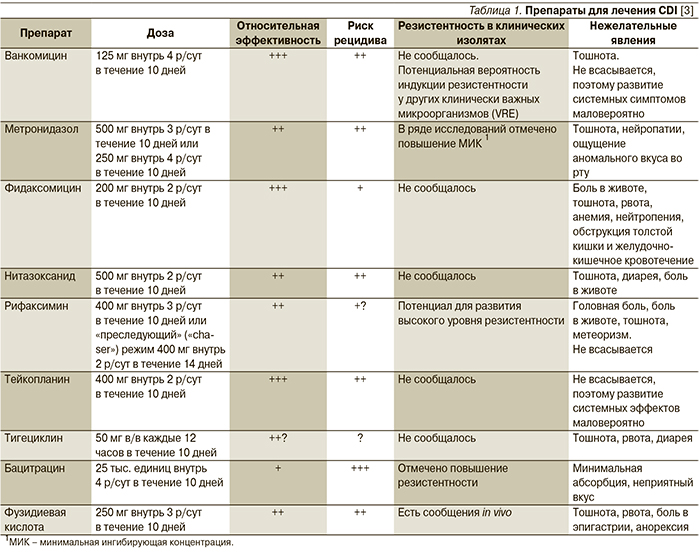
Терапия CDI зависит от тяжести заболевания. В легких случаях, проявляющихся диареей до 4 раз в сутки, не сопровождающейся общими симптомами и изменением лабораторных показателей, специфической терапии, как правило, не требуется. Достаточной мерой считаются восстановление водно-электролитного баланса и отмена антибиотика, если диарея развивается на фоне антибиотикотерапии. При более тяжелом течении заболевания с признаками колита показано назначение ЛС, эффективных в отношении C. difficile (табл. 1).
За последние 30 лет основными препаратами лечения CDI являются метронидазол и ванкомицин. По эффективности ванкомицин превосходит метронидазол [34, 35], однако в связи с риском распространения ванкомицин-резистентных энтерококков (VRE) в руководствах по лечению CDI ему рекомендуется отдавать предпочтение только при тяжелых формах заболевания, а в качестве препарата выбора при легких и среднетяжелых формах рассматривается метронидазол, хотя применение метронидазола также может приводить к колонизации VRE [36]. Для лечения токсического мегаколона рекомендуют комбинацию перорального ванкомицина и внутривенного метронидазола [37].
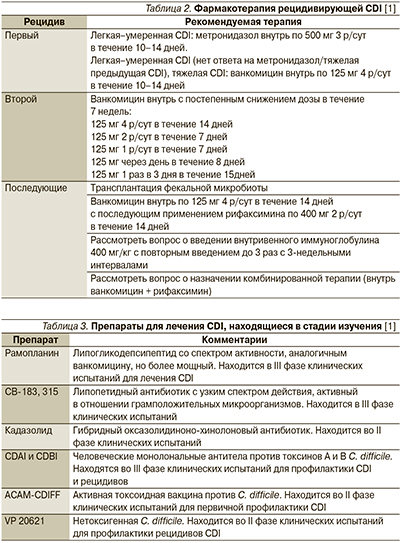
Активность в отношении C. difficile проявляет и ряд других антибиотиков (табл. 1), однако широкого применения в лечении CDI они не получили. Эффективность тейкопланина аналогична таковой ванкомицина, и он может быть альтернативой последнему [3]. Бацитрацин уступает по эффективности основным ЛС для лечения CDI вследствие быстрого развития резистентности и рассматривается в качестве резервного препарата [38]. Достоинством рифаксимина служит отсутствие у него неблагоприятного влияния на нормальную микрофлору кишечника [1]. Рифаксимин показан к лечению рецидивирующей инфекции при неэффективности стандартной терапии [38]. Препарат рекомендуется назначать в дозе 400 мг внутрь 2 р/сут в течение 14 дней сразу после завершения курса лечения вакомицином [1, 3]. Ванкомицин при рецидивах CDI применяют в виде пульс-терапии (по 125–500 мг через 1 или 2 дня) или в режиме постепенного снижения доз (табл. 2) [3].
 Антипротозойный препарат нитазоксанид при легкой и среднетяжелой CDI по эффективности сопоставим с метронидазолом [38]. Опыт применения тигециклина и фузидиевой кислоты ограничен, а исходы лечения этими препаратами противоречивы [3, 38]. Фузидиевую кислоту не рекомендуется использовать в виде монотерапии [3]. При множественных рецидивах возможно применение препаратов внутривенного иммуноглобулина, однако данные об его эффективности в отношении взрослых пациентов противоречивы [1, 39]. Кроме того, они вызывают побочные эффекты со стороны различных органов и систем, включая почечную недостаточность [1, 40]. Все большее внимание исследователей привлекают пробиотики. Положительные результаты получены в ряде исследований, особенно для Saccharomyces boulardii, Lactobacillus rhamnosus GG (LGG), а также комбинированных препаратов, содержащих 8 и более штаммов [41–43], однако для определения оптимальных штаммов микроорганизмов и режимов их применения необходимы дальнейшие исследования [44].
Антипротозойный препарат нитазоксанид при легкой и среднетяжелой CDI по эффективности сопоставим с метронидазолом [38]. Опыт применения тигециклина и фузидиевой кислоты ограничен, а исходы лечения этими препаратами противоречивы [3, 38]. Фузидиевую кислоту не рекомендуется использовать в виде монотерапии [3]. При множественных рецидивах возможно применение препаратов внутривенного иммуноглобулина, однако данные об его эффективности в отношении взрослых пациентов противоречивы [1, 39]. Кроме того, они вызывают побочные эффекты со стороны различных органов и систем, включая почечную недостаточность [1, 40]. Все большее внимание исследователей привлекают пробиотики. Положительные результаты получены в ряде исследований, особенно для Saccharomyces boulardii, Lactobacillus rhamnosus GG (LGG), а также комбинированных препаратов, содержащих 8 и более штаммов [41–43], однако для определения оптимальных штаммов микроорганизмов и режимов их применения необходимы дальнейшие исследования [44].
В дополнение к ЛС для лечения рецидивирующей CDI предложена пересадка фекальной микробиоты, эффективность которой показана в клинических исследованиях, включая мультицентровое [45]. Пациентам с множественными рецидивами пересадка фекальной микробиоты обеспечивает наиболее длительный период до наступления рецидива по сравнению со всеми другими видами терапии [46].
В стадии разработки находится ряд новых ЛС (табл. 3). Достаточно новым препаратом, вышедшим на международный фармацевтическиий рынок в 2011 г., считается фидаксомицин.
Фидаксомцин
Фидаксомицин одобрен для лечения кишечной инфекции, вызванной C. difficile, у лиц в возрасте 18 лет и старше в США (под торговым наименованием «Дифицид»), Евросоюзе (Дификлир), а также в Японии, Австралии и Канаде. Это первый представитель 18-членных макроциклических антибиотиков [3]. В США и Японии его относят к макролидным антибиотикам [3]. Фидаксомицин действует на РНК-полимеразу, приводя к быстрому нарушению синтеза РНК и как следствие – синтеза белка и ДНК [47]. Он более сильно ингибирует РНК-полимеразу клостридий, чем других бактерий, поэтому обладает узким спектром действия и характеризуется отличной активностью в отношении Clostridium spp., умеренной – в отношении грамположительных палочек и кокков, включая Staphylococcus spp., и энтерококков, включая VRE [48]. Активностью в отношении грамотрицательных микроорганизмов и грибов препарат не обладает.
Блокируя транскрипцию генов, фидаксомицин тормозит образование спор C. difficile и угнетает продукцию токсинов [49, 50]. Угнетение споруляции под влиянием препарата может способствовать снижению риска развития рецидивов и риска трансмиссии C. difficile в больницах и учреждениях длительного ухода. Токсины существенно реже обнаруживаются после лечения в фильтрате фекалий у пациентов, получавших фидаксомицин, по сравнению с пациентами, получавшими ванкомицин (14 и 28 % соответственно) [51].
Фидаксомицин оказывает бактерицидный эффект в отношении различных штаммов C. difficile, включая гипервирулентный NAP1/B1/027 [52]. Минимальная ингибирующая концентрация фидаксомицина для других штаммов ниже, чем у ванкомицина и метронидазола. Кроме того, фидаксомицин оказывает постантибиотический эффект, продолжающийся примерно в течение 10 часов, что позволяет принимать его дважды в сутки [53]. В отличие от метранидазола он плохо всасывается в ЖКТ и создает высокие концентрации в кале, значительно превышающие МИК для C. difficile, но очень низкие концентрации в крови. В связи с узким спектром действия фидаксомицин оказывает слабое влияние на микробиоту кишечника. Он преимущественно подавляет кластеры клостридий XIVa и IV и микроорганизмы, принадлежащие к группе бактероидов/превотелл и не влияет на бифидобактерии [50, 51, 54, 55]. Таким образом, при его применении создаются более благоприятные условия для быстрого восстановления микрофлоры, снижения риска колонизации C. difficile и реинфекции, чем при применении стандартной терапии [51]. У пациентов с исходно негативной культурой фидаксомицин снижает риск колонизации VRE и Candida spp., однако у пациентов с исходно позитивной культурой в отношении VRE после лечения наблюдается повышение МИК фидаксомицина для данного микроорганизма [54].
Основанием к регистрации фидаксомицина послужили результаты двух сравнительных с ванкомицином исследований пациентов с C. difficile-ассоциированной диарей III фазы. Участники исследований принимали оба препарата в течение 10 дней: фидаксомицин (n = 564) в дозе 200 мг 2 р/сут и ванкомицин (n = 583) в дозе 125 мг 4 р/сут [31, 32]. В обоих исследованиях частота излечения была одинаковой в группах фидаксомицина и ванкомицина (88,2 против 85,8 % и 91,7 против 90,6 % соответственно). Кроме того, в исследовании Cornely et al. фидаксомицин превосходил по эффективности ванкомицин в подгруппе пациентов, получавших сопутствующие антибиотики (90,2 против 73,3 %; p = 0,031) [32], а в исследовании Louie et al. – в подгруппе пациентов, инфицированных негипервирулентным штаммом C. difficile (7,8 против 25,5 %, p < 0,001) [31]. Кроме того, частота рецидивов за первые 4 недели после лечения у пациентов, получавших фидаксомицин, была значительно ниже, чем в группе сравнения (15,4 против 25,3 %, p = 0,005) [31]. Аналогичные результаты были получены и при ретроспективном анализе объединенных результатов двух исследований: излечение наступало для 90 % пациентов, получавших сопутствующие антибиотики, в группе фидаксомицина и для 79,4 % – в группе ванкомицина (p = 0,04), частота рецидива – у 16,9 и 29,2 % соответственно (p = 0,048) [56].
Согласно результатам ретроспективного мета-анализа результатов двух рандомизированных контролируемых исследований, фидаксомицин не уступал по эффективности ванкомицину в конце терапии, а в последующие 40 дней приводил к снижению на 40 % по сравнению с препаратом сравнения частоты персистирующей диареи, рецидива или смерти (p < 0,001), причем этот эффект не зависел от тяжести заболевания, наличия в анамнезе CDI и антибиотикотерапии этой инфекции, госпитального/амбулаторного статуса пациентов, исходного уровня альбуминов и креатинина [57]. Число участников с инфекцией, вызванной штаммами NAP1/BI/027, оказалось недостаточным, для того чтобы выявить статистически значимую разницу между эффективностью двух препаратов. Однако МИК90 фидаксомицина был одинаковым как для NAP1/BI/027, так и для других штаммов C. difficile.
В подгруппе онкологических больных лечение фидаксомицином ассоциировалось со значительным повышением по сравнению с ванкомицином вероятности достижения терапевтического (ОШ = 2,0; р = 0,065) и стойкого терапевтического ответа (ОШ = 2,56; р = 0,003) и со снижением риска развития рецидива (ОШ = 0,37; p = 0,018) [58]. У пациентов с рецидивом заболевания в течение 90 дней после первичного эпизода CDI (n = 178) фидаксомицин оказывал равный с ванкомицином терапевтический эффект, но приводил к достоверному снижению на 37 % частоты возникновения второго рецидива в течение 28 дней (20,3 против 32,3 %) [59].
Препарат хорошо переносится, в клинических исследованиях частота и профиль его побочных реакций не отличались от таковых у ванкомицина [2]. Широкое применение фидаксомицина ограничивает стоимость лечения. Средняя цена в США составляет 135 долл. за 200 мг фидаксомицина по сравнению с 0,72 долл. за 500 мг метронидазола и 31,81 долл. за 125 мг ванкомицина, а стоимость 10-дневного курса фидаксомицина в 125 раз превышает таковую 10-дневного курса метронидазола и в 2 раза – 10-дневного курса ванкомицина [2]. В реальной медицинской практике медиана стоимости лечения 1 пациента фидаксомицином составляет 19 483 долл. [60].
Таким образом, несмотря на достоинства фидаксомицина, его место в терапии CDI с учетом затратной эффективности еще предстоит определить в последующих исследованиях [61].



